Bernhard
Peter
Bungarotoxine
- die Nervengifte des Krait (1)
Wer ist
ein Krait?
Kraits (Gattung
Bungarus) sind Giftschlangen Südostasiens aus der Familie der
Elapiden (Giftnattern). Sie gehört zur Gruppe der
Proteroglyphen. Sie haben feststehende gefurchte Giftzähne im
Vordermaul, mit denen sie die Beute packen und beim Zupacken Gift
in diese injizieren. Kraits sind dämmerungs- und nachtaktiv. Sie
ernähren sich hauptsächlich von anderen kleinen Schlangen, ab
und zu auch von Eidechsen oder von kleinen Wirbeltieren wie
Mäusen und Vögeln. Eng verwandt sind Kraits mit den Kobras.
Kraits werden 1 m bis 1,80 m lang, wobei die Männchen eine
größere Länge als die Weibchen erreichen. Exemplare der Art
Bungarus fasciatus erreichen auch mal 2,1 m Länge. Typisch ist
der annähernd dreieckige Querschnitt des vergleichsweise dünnen
und schlanken Körpers. Deshalb nennen die Thai z. B. den
Bänder-Krait "Ngu Sam Liem", Dreieckschlange. Die
Zeichnung ist bei allen Arten ähnlich und besteht aus braunen
oder schwarzen Streifen auf hellem Körper oder aus dunklen
Sattelflecken auf einem hellen, weißlichen bis gelblichen Grund.
Die dunklen Flecken besitzen einen starken Glanz. Die Schuppen am
Rückengrat sind hexagonal. Der Kopf ist schlang; die Pupillen
sind rund. Im Gegensatz zu anderen Schlangen, die die Giftzähne
umlegen können, sind die Giftzähne der Kraits starr und nur 2-3
mm lang. So klein sie sind, das, was da herauskommt, reicht aus,
um hochgefährlich zu sein. Kraits vermehren sich über Eier, die
in Erdhöhlen oder ähnlichen Verstecken in einer Anzahl von 6-15
Stück abgelegt werden und bis zum Ausschlüpfen des Nachwuchses
von dem adulten Weibchen bewacht werden.
Wo kommen
Kraits vor?
12 Arten werden
unterschieden, mehrere davon mit Unterarten. Der
Verbreitungsschwerpunkt ist das tropische und subtropische
Südostasien. Das Gebiet ihres Vorkommens reicht vom indischen
Subkontinent im Westen bis nach Sulawesi im Osten. Offene und
feuchte Natur bietet ihnen ideale Lebensbedingungen, deswegen
findet man sie typischerweise am Rand bewässerter Flächen oder
Äcker oder im Grasland in Gewässernähe oder in niedrigen
Buschwäldern. Das macht es auch so gefährlich für die auf
diesen Flächen Landwirtschaft betreibenden Menschen. Daß nicht
mehr passiert liegt daran, daß die Kraits eigentlich scheu sind
und sich tagsüber unter Blätteransammlungen, in verlassenen
Termitenbauten oder in Erdhöhlen verbergen und erst bei
Dämmerung hervorkommen. Im einzelnen gibt es folgende
Verbreitungsgebiete:
Kraits fressen neben Eidechsen auch andere Schlangen und deren Eier. Dieses Verhalten nennt man ophiophag. Sie fressen andere kleine Schlangen, darunter auch giftige Arten, und sie ernähren sich sogar kannibalisch vom Nachwuchs anderer Artgenossen.
Wie
gefährlich sind Kraits?
Kraits sind tagsüber
defensiv und wenig angriffslustig, sie werden als friedlich und
beißunlustig beschrieben. Selbst bei Annähern und Reizen
verstecken sie eher ihren Kopf zwischen den Körperschlingen und
ziehen sich soweit wie möglich zurück. Die Schlangen meiden das Sonnenlicht. Werden sie tagsüber in ihrem Versteck (unter umgefallenen Bäumen und Totholz, in
verrottenden Baumstümpfen oder unter Steinen, Holzstapeln oder
Blechen) aufgedeckt, verfallen
sie oft auch in eine Art Lichtstarre. Sie sind tagsüber so
beißfaul, daß man auf Schlangenfarmen mit bloßen Händen mit
ihnen hantiert, großer Leichtsinn, aber üblich. In der Nacht
dagegen sind Kraits sehr aktiv und beißen wesentlich leichter
zu. Höchste Alarmstufe ist angesagt, wenn der Kopf unter
Körperschlingen zurückgezogen wird und das erhobene Schwanzende
hin und her bewegt wird, um abzulenken, dazu der Schlangenkörper
ruckelnde Bewegungen macht, dann steht bei weiterer
Bedrohungslage ein Angriff unmittelbar bevor, und der Kopf kann
jederzeit seitlich zwischen den Körperschlingen hervorschießen.
Die meisten Schlangenbisse ereignen sich daher nachts, wenn
Kraits auf der Jagd nach Kleintieren in menschliche Behausungen
eindringen und am Boden schlafende Personen beißen. Oben wurde
bereits erwähnt, daß die Giftzähne nur 2-3 mm lang sind,
deshalb ist ein Biß ncht besonders schmerzhaft und wird manchmal
auch gar nicht bemerkt oder für einen Dorn gehalten, auf den man
getreten ist. Das Nichtbemerken kostet unter Umständen wertvolle
Zeit.
Wo Kraits vorkommen, gehören sie mit zu den größten Gefahren. In Indien z. B. ist Bungarus caeruleus der gefährlichste Krait. Ca. ein Drittel aller Giftschlangenunfälle in West-Bengalen werden dieser Art zugeschrieben. Insgesamt sollen Bungarus caeruleus und Bungarus ceylonicus für 17 % der tödlichen Schlangenbisse und 10 % der Giftschlangenbisse verantwortlich sein. In Thailand gehen die meisten tödlichen Schlangenbisse auf das Konto von Kobras, Bungarus candidus und Calloselasma rhodostoma. In dem subtropischen Verbreitungsgebiet dieser Tiere ereignen sich Bißunfälle in erster Linie während der Monsunmonate (zw. Juni und September), das ist die Zeit, in der auch die Jungen aus den Eiern schlüpfen - sie haben trotz ihrer geringen Größe bereits einen voll entwickelten Giftapparat.
Folgende LD50-Werte (intravenös) finden sich in der Literatur:
Daher werden Kraits in Asien zu den medizinisch relevantesten Giftschlangen gezählt, und sie sind jedes Jahr für etliche Todesfälle verantwortlich. Wie gefährlich Kraits sind, zeigt der Fall des US-amerikanischen, für sein unkonventionelles Auftreten bekannten und brillianten Schlangenforschers (Herpetologen) Joseph Bruno Slowinski (15.11.1962-12.9.2001), nach dem immerhin drei Schlangenarten benannt sind, darunter auch Bungarus slowinskii. Er war im Rahmen einer wissenschaftlichen Expedition von 16 Fachleuten und 130 Trägern im Norden von Myanmar unterwegs, unter regenzeitbedingt miserablen Wegeverhältnissen mit Überflutungen. Ein Mitarbeiter verwechselte die Schlangen: Eigentlich sollte es der ungiftige Dinodon septentrionalis sein, ebenfalls schwarz-weiß gestreift und die Warntracht des Kraits perfekt imitierend, aber in dem ihm von jenem Mitarbeiter gereichten Sack, in den der Wissenschaftler morgens noch etwas müde und vielleicht auch etwas verkatert hineinfaßte (gefährlicher Leichtsinn des sich überlegen glaubenden Experten, potentiell giftige Schlangen mit bloßen Händen zu packen), um das Tier herauszuholen, steckte tatsächlich ein echtes junges Exemplar der hochgiftigen Krait der Art Bungarus multicinctus (Vielgebänderter Krait) und biß den Forscher in den Finger. Nach einer Stunde begannen die Hände zu kribbeln und zu zucken, und ab da ging es los mit der Vergiftungssymptomatik. Da er in einer abgelegenen Gegend mit schlechter medizinischer Versorgung unterwegs war, verstarb er an Atemversagen nach ca. 29 Stunden, inmitten von Fachleuten, selber Schlangenfachmann, doch die vor Ort möglichen Erste-Hilfe-Maßnahmen konnten selbst den Fachmann nicht retten. Zu Fuß hatte die Gruppe noch eine mehrere Stunden entfernte Militärbasis erreicht. Wegen schlechten Wetters (Monsun-Zeit, keine Sicht im Tal von Rat Baw) konnte ein angeforderter Hubschrauber aber nicht starten, und genau an dem Tag war die Kommunikation mit der amerikanischen Botschaft wegen bekannter anderer Ereignisse (WTC-Angriff 11.9.2001) und geschlossenen öffentlichen Einrichtungen schwierig. Mit Mund-zu-Mund-Beatmung konnte er noch 20 Stunden am Leben gehalten werden. Slowinski, Experte für asiatische Giftschlangen mit einem Faible für Kraits, wurde nur 38 Jahre alt. Der Helikopter kam zwar endlich, aber zu spät.
Wie wirkt
das Gift von Kraits?
Bei einem Biß der
Krait werden je nach Art und Situation nur ca. 8-30 mg des Gifts
injiziert. Ca. 6-10 mg wirken bereits tödlich beim Menschen. Am
Anfang einer Vergiftung kommen beim Menschen unspezifische Allgemeinsymptome vor, z. B.
Kopfschmerzen, Übelkeit, Erbrechen, Unterleibsschmerzen,
Durchfall, Schwindel. Es kann aber auch bereits im Frühstadium
zu einem Kreislaufschock kommen. Im Vordergrund des weiteren Verlaufs steht die
neurotoxische Wirkung: Die hochpotenten Gifte blockieren die
Kommunikation zwischen Gehirn und Muskeln. Sie greifen peripher
an, nicht zentral, denn sie würden die Blut-Hirn-Schranke nicht
überwinden können. Anfangs wird die Transmitterfreigabe
blockiert, was zu einer Phase der Paralyse führt. Dann folgt
eine Phase der massiven Übererregung mit Krämpfen und Zittern.
In einer dritten Phase kommt es zu einer länger anhaltenden
Paralyse. Je nach Opfer und Giftmenge können diese drei Phasen
in ihrer klinischen Ausprägung variieren.
Typische erste Anzeichen einer Vergiftung sind ein starrer Blick wegen der Lähmung der Augenmuskulatur und der Augenlider (schwere Oberlider), dann erstarrt die Gesichtsmuskulatur, die Lähmungen erfaßt auch die Gliedmaßen und schließlich die Atemmuskulatur, was schließlich zum Tod durch Atemstillstand führt - bei vollem Bewußtsein. Von den hospitalisierten Patienten kommt es bei ganz grob der Hälfte der Patienten innerhalb von 12 Stunden ohne Behandlung zu einem tödlichen Atemstillstand. Die Sterblichkeit kann durch künstliche Beatmung effektiv gesenkt werden. Trotzdem fallen sehr viele Patienten in eine unter Umständen tagelange Bewußtlosigkeit (Koma) mit Gedächtnisverlust.

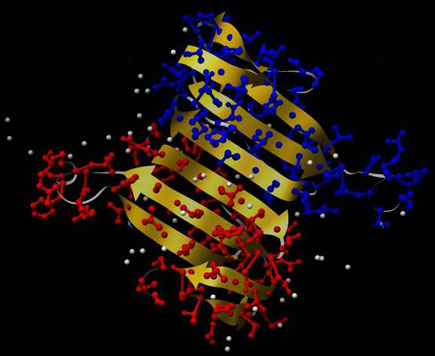
So ästhetisch kann ein tödliches Gift sein: 3D-Struktur von Kappa-1-Bungarotoxin mit Signalpeptid in kristalliner Form (Protein-Datenbank PDB: 1KBA), erzeugt mit Chimera. Die roten und blauen Teile sind die Seitenketten der beiden Hälften des Homodimers, das graue Band stellt das Rückgrat der Aminosäurenkette dar, die grauen Kugeln stehen für eingelagertes Wasser. Man achte auf die bilderbuchmäßig schön ausgeprägte Faltblattstruktur (gelbe Pfeile).
Was kann
man als Erste Hilfe tun?
Generell gelten die
in einem anderen Kapitel über Schlangenbisse vorgestellten Regeln. Jede körperliche
Anstrengung ist zu vermeiden. Wenn möglich, auf keinen Fall den
Patienten laufen lassen, sondern tragen oder am besten liegend
fahren. Denn jede Bewegung beschleunigt die Verteilung des Giftes
im Körper. Außerdem wirkt das Gift ja gerade durch Lähmung der
Muskeln - das Bewegen wird für den Patienten zunehmend schwer.
Und jede Bewegung ist mit einem erhöhten Sauerstoffbedarf
verbunden, was kontraproduktiv ist, da das Gift eine Atemlähmung
bewirkt. Zusätzlich ist es bei Bissen dieser Schlangen sinnvoll,
das betroffene Glied mit einer Bandage (Idealbinde, Kurzzugbinde)
relativ stamm von der betroffenen Stelle an zum Rumpf hin zu
wickeln und zu fixieren, um die Blutzirkulation einzuschränken (Immobilisierungs-Druckverband). Dies ist kein Abbinden! Alle anderen Regeln
gelten uneingeschränkt: Kein Einschneiden (Probleme mit
Gerinnungshemmung!), kein Aussaugen (wirkungslos!), kein
Ausschneiden oder Ausstechen (Risiko unkontrollierter Blutungen
wegen Gerinnungshemmung!), keine Eiskühlung (Gefahr von
Gewebsnekrosen!), nicht abbinden (Gefahr der Kompartimentierung
und des Gliedmaßenverlustes!). Der Immobilisierungs-Druckverband
wird bis zum Eintreffen in der Klinik nicht gelockert und erst
dann abgenommen, wenn das Gegengift zur Hand ist.
Was kann
der Arzt tun?
Jeder Biß einer
Krait ist lebensbedrohlich und als medizinischer Notfall zu
behandeln. Ohne professionelle Hilfe endet ein Angriffs- oder
Jagdbiß dieser Schlangen grundsätzlich in einem
lebensbedrohlichen Zustand und führt meist zum Tod. Nach
Einlieferung wird der Patient sorgfältig auf
Vergiftungsanzeichen hin beobachtet. Nur wenn innerhalb von 12
Stunden keine Symptome auftreten, hat der Patient Glück gehabt
und einen trockenen Biß abbekommen. Dann kann der
Immobilisierungs-Druckverband sukzessive unter Beobachtung des
Patienten gelöst werden. Innerhalb von 24 Szunden entscheidet
sich, ob dann doch noch Vergiftungszeichen auftreten oder ob der
Patient unbeschadet geblieben ist.
Wenn Symptome auftreten oder der Patient bereits mit auffälliger Symptomatik eingeliefert wurde, kann man in ärztlicher Obhut im wesentlichen nur mit intravenös verabreichtem Gegengift ("Tiger snake antivenom 3000 I. E., z. B. verdünnt in 60 ml Ringer-Laktat-Lösung, 2 ml pro Minute applizieren) arbeiten. Dabei ist insbesondere zu prüfen, obe es sich eventuell um multiple Bisse handelt, weil die Dosis entsprechend angepaßt werden muß. Ansonsten kann man nur symptomatisch behandeln, wobei die künstliche Beatmung im Vordergrund steht, um den Ausfall der Atmung zu kompensieren. Die sinnvollste medikamentöse Behandlung erfolgt mit Cholinesterase-Inhibitoren wie Physostigmin oder Neostigmin. Bei einer schweren Muskel-Paralyse kann man 0,6 mg Atropin geben, gefolgt von 0,5 mg Neostigmin alle halbe Stunde bis zu einem Maximum von fünf Dosen. Der Erfolg hängt von der beißenden Art ab, von der Menge des erhaltenen Gifts und vom Zeitpunkt des Behandlungsbeginns. Zur symptomatischen Behandlung können auch Corticosteroide, Epinephrin und Antihistaminika gehören, um allergischen Reaktionen entgegenzuwirken, die sich durch Husten, Atembeschwerden, Nesselsucht, Jucken, vermehrte Sekretion der Scheimhäute etc. andeuten können. Auch bei größten Schmerzen darf kein Morphin gegeben werden wegen der Atemdepression. Adjuvant sollte ein gutes Flüssigkeitsmanagement durch Ringerlactat-Infusionen erfolgen. Der Patient sollte intravenös versorgt werden, da durch die Muskellähmung beim Schluckvorgang Erstickungsrisko durch Aspiration besteht. Auch sollte auf Seitenlage geachtet werden wegen des Riskos der Verlegung der Atemwege durch die ebenso von der Lähmung betroffenen Zunge, außerdem muß mit Bewußtlosigkeit gerechnet werden. Und last, but not least, sollte der Tetanusstatus des Patienten überprüft werden und ggf. bei unklarem Impfstatus eine Tetanusprophylaxe mit entsprechenden Immunglobulinen durchgeführt werden.
Die größten Schwierigkeiten der medizinischen Behandlung in den Ländern, in denen Kraits vorkommen, ist zum einen die mangelnde Möglichkeit künstlicher Beatmung und die Wirksamkeit des Gegengiftes und die weiten Wege zur nächsten Behandlungsmöglichkeit.
Woraus
besteht Schlangengift eigentlich allgemein?
Schlangengift besteht
zu über 90% aus Proteinen, bezogen auf die wasserfreie Fraktion.
Die Proteine lassen sich einteilen in solche, die enzymatische
Eigenschaften haben, und solche, die Toxine darstellen. Enzyme im
Schlangengift machen aus diesem ein hochkonzentriertes
Verdauungssekret. Immerhin zerkleinert eine Schlange ihre Beute
nicht, sondern verdaut sie als Ganzes, die Injektion hochaktiver
Verdauungsenzyme löst die Beute von innen auf. Hämorrhagische
Auflösung des Gewebes nach Vipernbissen oder
Klapperschlangenbissen, Unterblutungen der Haut etc. sind die
Folge dieser enzymatischen Tätigkeit von Schlangengift. Die
andere Sorte, die Toxine, sind peptidische Gifte, die häufig
eine spezifische Wirkung an Zellmembranen haben, die
Erregungsleitung unterbrechen oder eine Lähmung herbeiführen.
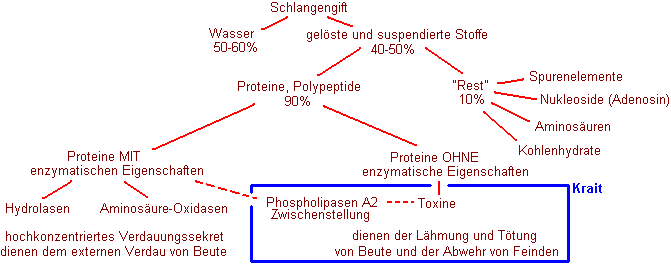
Daneben gibt es noch Stoffe, die eine Zwischenstellung zwischen Toxin (Giftstoff) und Enzym einnehmen, die Phospholipasen A2 (s.u.).
Gerade bei den Kraits stehen die Toxine im Vordergrund der Giftwirkung, es handelt sich um eine hochkomplexe Mischung verschiedener Nervengifte. Bei den Nervengiften der Kraits handelt es sich ausschließlich um Protein-Gifte aus ca. 63-95 Aminosäuren. Es werden mehrere Gruppen unterschieden:
Alpha-Neurotoxine
Das Alpha-Neurotoxin
ist ein post-synaptisch angreifendes Neurotoxin, das irreversibel
an den nicotinischen Acetylcholin-Rezeptor bindet und
neuromusculäre Blockaden erzeugt und zu Paralyse der
Skelettmuskulatur führt. Das verhindert die Öffnung von mit dem
nicotinischen Acetylcholin-Rezeptor assoziierten Ionenkanälen.
Die Wirkung ist eine postsynaptische wie beim Kappa-Bungarotoxin
und im Gegensatz zum Beta-Bungarotoxin, das präsynaptisch wirkt.
Die Blockade der motorischen Endplatten steht im Vordergrund. Bei
Kraits kommen zwei Isoformen der Alpha-Bungaotoxine vor. Das
Alpha-Bungarotoxin bindet so fest an den Acetylcholin-Rezeptor,
daß es im Labor zum Markieren dieser Kanäle benutzt wird.

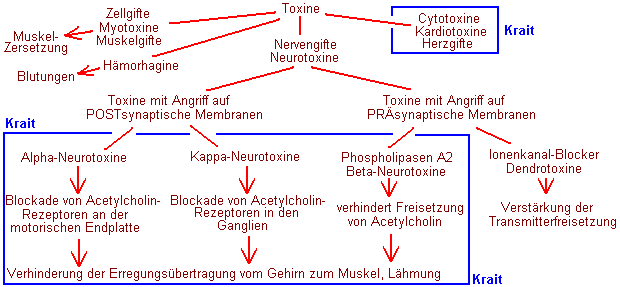
Abb.: Alpha-Bungarotoxin, A-Kette (Protein-Datenbank SCOP 44424), erzeugt mit Chimera.
Kappa-Neurotoxine:
Beim Kappa-Neurotoxin
handelt es sich um ein Neurotoxin, welches ebenfalls an den
postsynaptischen nicotinischen Rezeptor für Acetylcholin bindet
und diesen blockiert. Die Wirkung ist eine postsynaptische wie
beim Alpha-Bungarotoxin und im Gegensatz zum Beta-Bungarotoxin,
das präsynaptisch wirkt. Es ist ein reversibler Antagonist. Im
Vergleich zu Alpha-Toxinen binden Kappa-Toxine stärker an
neuronale Rezeptoren und weniger stark an Muskel-Rezeptoren. Der
Hauptangriffsbereich sind also die Nervenknoten (Ganglien), wo
die Signalweiterleitung unterbrochen wird. Bei Kraits kommen
mindestens sechs verschiedene Kappa-Neurotoxine vor.
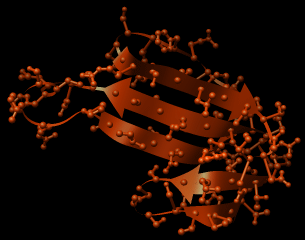
Abb.: Kappa-1-Bungarotoxin, A-Kette (Protein-Datenbank SCOP 44431), erzeugt mit Chimera. Böse Zungen behaupten, ich hätte dieses Kapitel nur wegen der schönen Graphiken geschrieben....
Beta-Neurotoxine,
Phospholipasen A2:
Die Beta-Neurotoxine
sind ebenfalls Nervengifte, aber die Vertreter dieser Sorte
binden an eine präsynaptische Membran und verhindern dort die
Ausschüttung des Botenstoffes Acetylcholin, der die Erregung
weiterleiten soll. Auch so versiegt das Signal, es kommt in Folge
zu Lähmungen. Beta-Bungarotoxin bildet ein Heterodimer. Es kommt
in zwei Formen vor, Beta-1-Bungarotoxin und Beta-2-Bungarotoxin.
Die Wirkung ist eine präsynaptische im Gegensatz zum
Alpha-Bungarotoxin und zum Kappa-Bungarotoxin, die beide
postsynaptisch wirken. Die Wirkung der
Beta-Neurotoxine tritt in Relation zu Alpha- und
Kappa-Bungarotoxinen zeitverzögert ein. Es handelt sich um neurotoxische
Phospholipasen A2, also eigentlich Enzyme, die Phospholipide
hydrolysieren. Daher besitzt diese Gruppe eine Sonderstellung: Es
handelt sich sowohl um Enzyme als auch um Gifte, also Enzyme, die
wie Gifte wirken. Von den Phospholipasen A2 gibt es viele
verschiedene Sorten, unter anderem solche, die die Muskulatur
auflösen wie beim Taipan, oder solche, die die neuromuskuläre
Kommunikation unterbrechen wie bei den Kraits.
Neben diesen wichtigen Gruppen gibt es in dem Gift der Kraits auch noch Gamma-Toxine, Cardiotoxine, die auf das Herz gehen, sowie viele weitere Nervengifte.
Sequenz
der Schlangengifte der Gattung Bungarus:
In der Zelle wird an
den Ribosomen ein längeres Protein synthetisiert, eine Vorstufe
des eigentlichen Giftes. Der Anfang der Gifte besteht aus 21
Aminosäuren gleicher oder äußerst ähnlicher Abfolge, die das
sogenannte Signalpeptid darstellen. Das Signalpeptid sorgt
dafür, daß das Gift durch die Membran des endoplasmatischen
Retikulums geschleust wird und dort weitertransportiert wird.
Nach dem Membrandurchtritt hat das Signalpeptid seine Funktion
erfüllt und wird abgespalten. Der Rest, also die Vorstufe
abzüglich der ersten 21 Aminosäuren, stellt das eigentliche
Gift dar, wie in der nachfolgenden Abbildung für drei
verschiedene Gifte illustriert wird.

Es gibt, wie oben beschrieben, mehrere Gruppen von Giften, die jeweils als Alpha-, Kappa- etc. Toxine zusammengefaßt werden. Es sind jeweils nur wenige Aminosäuren, die ausgetauscht sind. Die folgende Abbildung illustriert die strukturelle Ähnlichkeit insbesondere der Kappa-Toxine untereinander.

Bungarotoxine
- die Nervengifte des Krait (2)
Knallharte Proteinchemie:
Hier werden detailliert einige Gifte aus Bungarus-Arten beschrieben inclusive ihrer Aminosäuresequenz. Die Auflistung erhebt keinerlei Anspruch auf Vollständigkeit. Wer kein Hardcore-Schlangengiftchemie-Fan ist, sollte diesen Abschnitt besser nicht lesen, sondern sich einfach die hübschen Bildchen anschauen.
Alpha-Bungarotoxin,
Vorstufe der A31-Isoform, Alpha-BTX-A31, BGTX A31, Langes
Neurotoxin 1)
Vorkommen in
Schlange: Bungarus multicinctus (vielfach gebänderter Krait,
Vielbinden-Krait, Vielbindenbungar)
Anzahl der Aminosäuren: 95
Protein-Datenbank: 2ABX, 1ABT
Sequenz: MKTLLLTLVV VTIVCLDLGY TIVCHTTATS PISAVTCPPG ENLCYRKMWC
DAFCSSRGKV VELGCAATCP SKKPYEEVTC CSTDKCNPHP KQRPG
Met-Lys-Thr-Leu-Leu-Leu-Thr-Leu-Val-Val-Val-Thr-Ile-Val-Cys-Leu-Asp-Leu-Gly-
Tyr-Thr-Ile-Val-Cys-His-Thr-Thr-Ala-Thr-Ser-Pro-Ile-Ser-Ala-Val-Thr-Cys-Pro-Pro-Gly-Glu-
Asn-Leu-Cys-Tyr-Arg-Lys-Met-Trp-Cys-Asp-Ala-Phe-Cys-Ser-Ser-Arg-Gly-Lys-Val-
Val-Glu-Leu-Gly-Cys-Ala-Ala-Thr-Cys-Pro-Ser-Lys-Lys-Pro-Tyr-Glu-Glu-Val-Thr-Cys-
Cys-Ser-Thr-Asp-Lys-Cys-Asn-Pro-His-Pro-Lys-Gln-Arg-Pro-Gly
Disulfid-Brücken: 24-44, 37-65, 50-54, 69-80, 81-86
Molekulargewicht: 10285 g/mol
In Lösung liegt das Protein monomer vor, im Kristall wird aus
zwei gleichen Einweißen ein Homodimer gebildet. Die hier
gelistete Vorstufe besteht von Position 1-21 aus einem
Signalpeptid, welches beim weiteren Prozessieren abgespalten
wird. Das eigentliche Alpha-Bungarotoxin liegt in den Positionen
22-95.
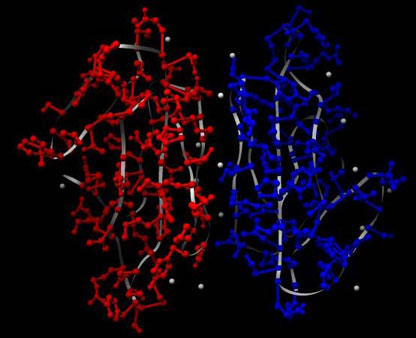
Abb.: 3D-Struktur von Alpha-Bungarotoxin in kristalliner Form (Protein-Datenbank PDB: 2ABX), erzeugt mit Chimera. Die roten und blauen Teile sind die beiden Hälften des Homodimers, die grauen Kugeln stellen eingelagertes Wasser dar. Man achte auf das Fehlen von Helices oder Faltblattstrukturen.
Alpha-Bungarotoxin,
a-Bungarotoxin (a-BuTx, BGTX), A31-Isoform
Anzahl der
Aminosäuren: 74
Protein-Datenbank: 2ABX, 1ABT, 1HC9 (komplexiert)
Sequenz: IVCHTTATSP ISAVTCPPGE NLCYRKMWCD AFCSSRGKVV ELGCAATCPS
KKPYEEVTCC STDKCNPHPK QRPG
Ile-Val-Cys-His-Thr-Thr-Ala-Thr-Ser-Pro-Ile-Ser-Ala-Val-Thr-Cys-Pro-Pro-Gly-Glu-
Asn-Leu-Cys-Tyr-Arg-Lys-Met-Trp-Cys-Asp-Ala-Phe-Cys-Ser-Ser-Arg-Gly-Lys-Val-
Val-Glu-Leu-Gly-Cys-Ala-Ala-Thr-Cys-Pro-Ser-Lys-Lys-Pro-Tyr-Glu-Glu-Val-Thr-Cys-
Cys-Ser-Thr-Asp-Lys-Cys-Asn-Pro-His-Pro-Lys-Gln-Arg-Pro-Gly
Disulfid-Brücken: 3-23, 16-44, 29-33, 48-59, 60-65
Molekulargewicht: 7994 g/mol
CAS-Nummer: [11032-79-4 ], Merck-Index: 13: 1476
Von beiden, dem Alpha-Bungarotoxin und von seiner Vorstufe, gibt es noch eine Isoform mit V statt an Position 31. Alles andere inclusive der Disulfidbrücken stimmt überein. Die Vorstufe hat ein Molekulargewicht von 10313 g/mol, das Toxin eines von 8022 g/mol.
Kappa-1-Bungarotoxin-Vorstufe
(Langes Neuotoxin 2, neuronales Bungarotoxin, Toxin F)
Vorkommen in
Schlange: Bungarus multicinctus (vielfach gebänderter Krait,
Vielbinden-Krait, Vielbindenbungar)
Anzahl der Aminosäuren: 87
Protein-Datenbank: 1KBA, 2NBT
Sequenz: MKTLLLTLVV VTIVCLDLGY TRTCLISPSS TPQTCPNGQD ICFLKAQCDK
FCSIRGPVIE QGCVATCPQF RSNYRSLLCC TTDNCNH
Met-Lys-Thr-Leu-Leu-Leu-Thr-Leu-Val-Val-Val-Thr-Ile-Val-Cys-Leu-Asp-Leu-Gly-Tyr-Thr-
Arg-Thr-Cys-Leu-Ile-Ser-Pro-Ser-Ser-Thr-Pro-Gln-Thr-Cys-Pro-Asn-Gly-Gln-Asp-Ile-Cys-Phe-
Leu-Lys-Ala-Gln-Cys-Asp-Lys-Phe-Cys-Ser-Ile-Arg-Gly-Pro-Val-Ile-Glu-Gln-Gly-Cys-Val-Ala-
Thr-Cys-Pro-Gln-Gln-Phe-Arg-Ser-Asn-Tyr-Arg-Ser-Leu-Leu-Cys-Cys-Thr-Thr-Asp-Asn-Cys-Asn-His
Disulfid-Brücken: 24-42, 35-63, 48-52, 67-79, 80-85
Molekulargewicht: 9566 g/mol
Das ist die Vorstufe des Kappa-1-Bungarotoxins. Die Positionen
1-21 sind das Signalpeptid, die Positionen 22-87 das
Kappa-1-Bungarotoxin. Das Signalpeptid wird beim Ausschleusen
abgespalten. Dieses Eiweiß liegt als Homodimer vor.

Abb.: 3D-Struktur von Kappa-1-Bungarotoxin mit Signalpeptid in kristalliner Form (Protein-Datenbank PDB: 1KBA), erzeugt mit Chimera.
Kappa-1-Bungarotoxin
Anzahl der
Aminosäuren: 66
Sequenz: RTCLISPSST PQTCPNGQDI CFLKAQCDKF CSIRGPVIEQ GCVATCPQFR
SNYRSLLCCT TDNCNH
Arg-Thr-Cys-Leu-Ile-Ser-Pro-Ser-Ser-Thr-Pro-Gln-Thr-Cys-Pro-Asn-Gly-Gln-Asp-Ile-
Cys-Phe-Leu-Lys-Ala-Gln-Cys-Asp-Lys-Phe-Cys-Ser-Ile-Arg-Gly-Pro-Val-Ile-Glu-Gln-
Gly-Cys-Val-Ala-Thr-Cys-Pro-Gln-Gln-Phe-Arg-Ser-Asn-Tyr-Arg-Ser-Leu-Leu-Cys-
Cys-Thr-Thr-Asp-Asn-Cys-Asn-His
Disulfid-Brücken: 3-21, 14-42, 27-31, 46-58, 59-64
Molekulargewicht: 7275 g/mol
Entsteht aus der Vorstufe (s.o.) durch Abspalten des
Signalpeptids.
Kappa-2-Bungarotoxin-Vorstufe,
Langes Neurotoxin CB1, Kappa-Neurotoxin, Vorstufe eines langen
Neurotoxins
Vorkommen in
Schlange: Bungarus multicinctus (vielfach gebänderter Krait,
Vielbinden-Krait, Vielbindenbungar)
Anzahl der Aminosäuren: 87
Sequenz: MKTLLLTLVV VTIVCLDLGY TKTCLKTPSS TPQTCPQGQD ICFLKVSCEQ
FCPIRGPVIE QGCAATCPEF RSNDRSLLCC TTDNCNH
Met-Lys-Thr-Leu-Leu-Leu-Thr-Leu-Val-Val-Val-Thr-Ile-Val-Cys-Leu-Asp-
Leu-Gly-Tyr-Thr-Lys-Thr-Cys-Leu-Lys-Thr-Pro-Ser-Ser-Thr-Pro-Gln-Thr-
Cys-Pro-Gln-Gly-Gln-Asp-Ile-Cys-Phe-Leu-Lys-Val-Ser-Cys-Glu-Gln-Phe-
Cys-Pro-Ile-Arg-Gly-Pro-Val-Ile-Glu-Gln-Gly-Cys-Ala-Ala-Thr-Cys-Pro-Glu-
Phe-Arg-Ser-Asn-Asp-Arg-Ser-Leu-Leu-Cys-Cys-Thr-Thr-Asp-Asn-Cys-Asn-His
Disulfid-Brücken: 24-42, 35-63, 48-52, 67-79, 80-85
Molekulargewicht: 9517 g/mol
Homodimer und Heterodimer mit Kappa-3-Bungarotoxin.
Ist eine Vorstufe. Entspricht von Position 22-87 dem
Kappa-2-Bungarotoxin. Das Stück 1-21 ist ein Signalpeptid, das
später abgespalten wird.
Kappa-2-Bungarotoxin
Anzahl der
Aminosäuren: 66
Sequenz: KTCLKTPSST PQTCPQGQDI CFLKVSCEQF CPIRGPVIEQ GCAATCPEFR
SNDRSLLCCT TDNCNH
Lys-Thr-Cys-Leu-Lys-Thr-Pro-Ser-Ser-Thr-Pro-Gln-Thr-Cys-Pro-Gln-Gly-
Gln-Asp-Ile-Cys-Phe-Leu-Lys-Val-Ser-Cys-Glu-Gln-Phe-Cys-Pro-Ile-Arg-
Gly-Pro-Val-Ile-Glu-Gln-Gly-Cys-Ala-Ala-Thr-Cys-Pro-Glu-Phe-Arg-Ser-
Asn-Asp-Arg-Ser-Leu-Leu-Cys-Cys-Thr-Thr-Asp-Asn-Cys-Asn-His
Entsteht aus der Vorstufe (s.o.) durch Abspalten des
Signalpeptids.
Kappa-3-Bungarotoxin-Vorstufe,
langes Neurotoxin CR, Kappa-Neurotoxin, Vorstufe eines langen
Neurotoxins
Vorkommen in
Schlange: Bungarus multicinctus (vielfach gebänderter Krait,
Vielbinden-Krait, Vielbindenbungar)
Anzahl der Aminosäuren: 87
Sequenz: MKTLLLSLVV VTIVCLDLGY TRTCLISPSS TPQTCPNGQD ICFRKAQCDN
FCHSRGPVIE QGCVATCPQF RSNYRSLLCC RTDNCNH
Met-Lys-Thr-Leu-Leu-Leu-Ser-Leu-Val-Val-Val-Thr-Ile-Val-Cys-Leu-Asp-
Leu-Gly-Tyr-Thr-Arg-Thr-Cys-Leu-Ile-Ser-Pro-Ser-Ser-Thr-Pro-Gln-Thr-Cys-
Pro-Asn-Gly-Gln-Asp-Ile-Cys-Phe-Arg-Lys-Ala-Gln-Cys-Asp-Asn-Phe-Cys-
His-Ser-Arg-Gly-Pro-Val-Ile-Glu-Gln-Gly-Cys-Val-Ala-Thr-Cys-Pro-Gln-Phe-
Arg-Ser-Asn-Tyr-Arg-Ser-Leu-Leu-Cys-Cys-Arg-Thr-Asp-Asn-Cys-Asn-His
Disulfid-Brücken: 24-42, 35-63, 48-52, 67-79, 80-85
Molekulargewicht: 9660 g/mol
Bildet ein Homodimer und ein Heterodimer mit
Kappa-2-Bungarotoxin.
Das Protein ist eine Vorstufe. Es entspricht von Position 22-87
dem Kappa-3-Bungarotoxin. Das Stück 1-21 ist ein Signalpeptid,
das später im Verlauf der Prozessierung abgespalten wird.
Kappa-3-Bungarotoxin
Anzahl der
Aminosäuren: 66
Sequenz: RTCLISPSST PQTCPNGQDI CFRKAQCDNF CHSRGPVIEQ GCVATCPQFR
SNYRSLLCCR TDNCNH
Arg-Thr-Cys-Leu-Ile-Ser-Pro-Ser-Ser-Thr-Pro-Gln-Thr-Cys-Pro-Asn-Gly-
Gln-Asp-Ile-Cys-Phe-Arg-Lys-Ala-Gln-Cys-Asp-Asn-Phe-Cys-His-Ser-Arg-
Gly-Pro-Val-Ile-Glu-Gln-Gly-Cys-Val-Ala-Thr-Cys-Pro-Gln-Phe-Arg-Ser-Asn-
Tyr-Arg-Ser-Leu-Leu-Cys-Cys-Arg-Thr-Asp-Asn-Cys-Asn-His
Dieses Bungarotoxin entsteht aus der Vorstufe (s.o.) durch
Abspalten des Signalpeptids.
Kappa-4-Bungarotoxin-Vorstufe
Vorkommen in
Schlange: Bungarus multicinctus (vielfach gebänderter Krait,
Vielbinden-Krait, Vielbindenbungar)
Anzahl der Aminosäuren: 87
Sequenz: MKTLLLTLVV VTIVCLDLGY TRTCLISPSS PPQTCPKGED ICIVKARCDE
WCLRRGPLIE RGCAATCPEF RSNYRSLLCC TTDNCNH
Met-Lys-Thr-Leu-Leu-Leu-Thr-Leu-Val-Val-Val-Thr-Ile-Val-Cys-Leu-Asp-Leu-
Gly-Tyr-Thr-Arg-Thr-Cys-Leu-Ile-Ser-Pro-Ser-Ser-Pro-Pro-Gln-Thr-Cys-Pro-
Lys-Gly-Glu-Asp-Ile-Cys-Ile-Val-Lys-Ala-Arg-Cys-Asp-Glu-Trp-Cys-Leu-Arg-
Arg-Gly-Pro-Leu-Ile-Glu-Arg-Gly-Cys-Alal-Ala-Thr-Cys-Pro-Glu-Phe-Arg-Ser-
Asn-Tyr-Arg-Ser-Leu-Leu-Cys-Cys-Thr-Thr-Asp-Asn-Cys-Asn-His
Disulfid-Brücken: 24-42, 35-63, 48-52, 67-79, 80-85
Molekulargewicht: 9660 g/mol
Auch das ist eine Vorstufe. Das Protein entspricht von Position
22-87 dem Kappa-4-Bungarotoxin. Das Stück 1-21 ist ein
Signalpeptid, das später im Zuge der Prozessierung abgespalten
wird.
Kappa-4-Bungarotoxin
Anzahl der
Aminosäuren: 66
Sequenz: RTCLISPSS PPQTCPKGED ICIVKARCDE WCLRRGPLIE RGCAATCPEF
RSNYRSLLCC TTDNCNH
Arg-Thr-Cys-Leu-Ile-Ser-Pro-Ser-Ser-Pro-Pro-Gln-Thr-Cys-Pro-Lys-
Gly-Glu-Asp-Ile-Cys-Ile-Val-Lys-Ala-Arg-Cys-Asp-Glu-Trp-Cys-Leu-Arg-
Arg-Gly-Pro-Leu-Ile-Glu-Arg-Gly-Cys-Alal-Ala-Thr-Cys-Pro-Glu-Phe-
Arg-Ser-Asn-Tyr-Arg-Ser-Leu-Leu-Cys-Cys-Thr-Thr-Asp-Asn-Cys-Asn-His
Dieses Bungarotoxin entsteht aus der Vorstufe (s.o.) durch
Abspalten des Signalpeptids.
Kappa-5-Bungarotoxin-Vorstufe
Vorkommen in
Schlange: Bungarus multicinctus (vielfach gebänderter Krait,
Vielbinden-Krait, Vielbindenbungar)
Anzahl der Aminosäuren: 87
Sequenz: MKTLLLTLVV VTIVCLDLGY TKTCLISPSS TPQTCPQGQD TCFLKALCDK
LCPIRGPVIE QGCAATCPEF RSNYRSLLCC TTDNCNH
Met-Lys-Thr-Leu-Leu-Leu-Thr-Leu-Val-Val-Val-Thr-Ile-Val-Cys-Leu-Asp-
Leu-Gly-Tyr-Thr-Lys-Thr-Cys-Leu-Ile-Ser-Pro-Ser-Ser-Thr-Pro-Gln-Thr-Cys-
Pro-Gln-Gly-Gln-Asp-Thr-Cys-Phe-Leu-Lys-Ala-Leu-Cys-Asp-Lys-Leu-Cys-
Pro-Ile-Arg-Gly-Pro-Val-Ile-Glu-Gln-Gly-Cys-Ala-Ala-Thr-Cys-Pro-Glu-Phe-Arg-
Ser-Asn-Tyr-Arg-Ser-Leu-Leu-Cys-Cys-Thr-Thr-Asp-Asn-Cys-Asn-His
Disulfid-Brücken: 24-42, 35-63, 48-52, 67-79, 80-85
Molekulargewicht: 9474 g/mol
Auch das ist eine Vorstufe. Es entspricht von Position 22-87 dem
Kappa-5-Bungarotoxin. Das Stück 1-21 ist ein Signalpeptid, das
später bei der Prozessierung abgespalten wird.
Kappa-5-Bungarotoxin
Anzahl der
Aminosäuren: 66
Sequenz: KTCLISPSS TPQTCPQGQD TCFLKALCDK LCPIRGPVIE QGCAATCPEF
RSNYRSLLCC TTDNCNH
Lys-Thr-Cys-Leu-Ile-Ser-Pro-Ser-Ser-Thr-Pro-Gln-Thr-Cys-Pro-Gln-Gly-Gln-
Asp-Thr-Cys-Phe-Leu-Lys-Ala-Leu-Cys-Asp-Lys-Leu-Cys-Pro-Ile-Arg-Gly-Pro-
Val-Ile-Glu-Gln-Gly-Cys-Ala-Ala-Thr-Cys-Pro-Glu-Phe-Arg-Ser-Asn-Tyr-Arg-Ser-
Leu-Leu-Cys-Cys-Thr-Thr-Asp-Asn-Cys-Asn-His
Entsteht aus der Vorstufe (s.o.) durch Abspalten des
Signalpeptids.
Kappa-6-Bungarotoxin-Vorstufe
Vorkommen in
Schlange: Bungarus multicinctus (vielfach gebänderter Krait,
Vielbinden-Krait, Vielbindenbungar)
Anzahl der Aminosäuren: 87
Sequenz: MKTLLLSLVV VTIVCLDLGY TRTCHISTSS TPQTCPKGQD ICFRKTQCDK
FCSIRGAVIE QGCVATCPEF RSNYRSLLCC RTDNCNP
Met-Lys-Thr-Leu-Leu-Leu-Ser-Leu-Val-Val-Val-Thr-Ile-Val-Cys-Leu-Asp-
Leu-Gly-Tyr-Thr-Arg-Thr-Cys-His-Ile-Ser-Thr-Ser-Ser-Thr-Pro-Gln-Thr-Cys-
Pro-Lys-Gly-Gln-Asp-Ile-Cys-Phe-Arg-Lys-Thr-Gln-Cys-Asp-Lys-Phe-Cys-Ser-
Ile-Arg-Gly-Ala-Val-Ile-Glu-Gln-Gly-Cys-Val-Ala-Thr-Cys-Pro-Glu-Phe-Arg-Ser-
Asn-Tyr-Arg-Ser-Leu-Leu-Cys-Cys-Arg-Thr-Asp-Asn-Cys-Asn-Pro
Disulfid-Brücken: 24-42, 35-63, 48-52, 67-79, 80-85
Molekulargewicht: 9657 g/mol
Ist eine Vorstufe. Entspricht von Position 22-87 dem
Kappa-6-Bungarotoxin. Das Stück 1-21 ist ein Signalpeptid, das
später abgespalten wird.
Kappa-6-Bungarotoxin
Anzahl der
Aminosäuren: 66
Sequenz: RTCHISTSST PQTCPKGQDI CFRKTQCDKF CSIRGAVIEQ GCVATCPEFR
SNYRSLLCCR TDNCNP
Arg-Thr-Cys-His-Ile-Ser-Thr-Ser-Ser-Thr-Pro-Gln-Thr-Cys-Pro-Lys-Gly-Gln-Asp-Ile-
Cys-Phe-Arg-Lys-Thr-Gln-Cys-Asp-Lys-Phe-Cys-Ser-Ile-Arg-Gly-Ala-Val-Ile-Glu-Gln-
Gly-Cys-Val-Ala-Thr-Cys-Pro-Glu-Phe-Arg-Ser-Asn-Tyr-Arg-Ser-Leu-Leu-Cys-Cys-
Arg-Thr-Asp-Asn-Cys-Asn-Pro
Entsteht aus der Vorstufe (s.o.) durch Abspalten des
Signalpeptids.
Gamma-Bungarotoxin-Vorstufe
1, Langes Neurotoxin-Homologes NTL2I
Vorkommen in
Schlange: Bungarus multicinctus (vielfach gebänderter Krait,
Vielbinden-Krait, Vielbindenbungar)
Anzahl der Aminosäuren: 89
Sequenz: MKTLLLTLVV VTIVCLDLGY TMQCKTCSFY TCPNSETCPD GKNICVKRSW
TAVRGDGPKR EIRRECAATC PPSKLGLTVF CCTTDNCNH
Met-Lys-Thr-Leu-Leu-Leu-Thr-Leu-Val-Val-Val-Thr-Ile-Val-Cys-Leu-Asp-Leu-
Gly-Tyr-Thr-Met-Gln-Cys-Lys-Thr-Cys-Ser-Phe-Tyr-Thr-Cys-Pro-Asn-Ser-Glu-
Thr-Cys-Pro-Asp-Gly-Lys-Asn-Ile-Cys-Val-Lys-Arg-Ser-Trp-Thr-Ala-Val-Arg-Gly-Asp-
Gly-Pro-Lys-Arg-Glu-Ile-Arg-Arg-Glu-Cys-Ala-Ala-Thr-Cys-Pro-Pro-Ser-Lys-Leu-Gly-
Leu-Thr-Val-Phe-Cys-Cys-Thr-Thr-Asp-Asn-Cys-Asn-His
Disulfid-Brücken: 24-45, 27-32, 38-66, 70-81, 82-87
Molekulargewicht: 9826 g/mol
Ist eine Vorstufe. Entspricht von Position 22-89 dem
Gamma-Bungarotoxin. Das Stück 1-21 ist ein Signalpeptid, das
später abgespalten wird.
Gamma-Bungarotoxin-Vorstufe
2, Langes Neurotoxin-Homologes
Vorkommen in
Schlange: Bungarus multicinctus (vielfach gebänderter Krait,
Vielbinden-Krait, Vielbindenbungar)
Anzahl der Aminosäuren: 89
Sequenz: METLLLTLVV VTIVCLDLGY TMQCKTCSFY TCPNSETCPD GKNICVKRSW
TAVRGDGPKR EIRRECAATC PPSKLGLTVF CCTTDNCNH
Met-Glu-Thr-Leu-Leu-Leu-Thr-Leu-Val-Val-Val-Thr-Ile-Val-Cys-Leu-Asp-
Leu-Gly-Tyr-Thr-Met-Gln-Cys-Lys-Thr-Cys-Ser-Phe-Tyr-Thr-Cys-Pro-Asn-
Ser-Glu-Thr-Cys-Pro-Asp-Gly-Lys-Asn-Ile-Cys-Val-Lys-Arg-Ser-Trp-Thr-Ala-
Val-Arg-Gly-Asp-Gly-Pro-Lys-Arg-Glu-Ile-Arg-Arg-Glu-Cys-Ala-Ala-Thr-Cys-
Pro-Pro-Ser-Lys-Leu-Gly-Leu-Thr-Val-Phe-Cys-Cys-Thr-Thr-Asp-Asn-Cys-Asn-His
Disulfid-Brücken: 24-45, 27-32, 38-66, 70-81, 82-87
Molekulargewicht: 9826 g/mol
Ist eine Vorstufe, unterscheidet sich von der vorherigen Vorstufe
nur in einer einzigen Aminosäure (2) des Signalpeptides.
Entspricht von Position 22-89 dem Gamma-Bungarotoxin. Das Stück
1-21 ist das Signalpeptid, welches später abgespalten wird.
Gamma-Bungarotoxin
Anzahl der
Aminosäuren: 68
Sequenz: MQCKTCSFYT CPNSETCPDG KNICVKRSWT AVRGDGPKRE IRRECAATCP
PSKLGLTVFC CTTDNCNH
Met-Gln-Cys-Lys-Thr-Cys-Ser-Phe-Tyr-Thr-Cys-Pro-Asn-Ser-Glu-Thr-Cys-Pro-
Asp-Gly-Lys-Asn-Ile-Cys-Val-Lys-Arg-Ser-Trp-Thr-Ala-Val-Arg-Gly-Asp-Gly-Pro-
Lys-Arg-Glu-Ile-Arg-Arg-Glu-Cys-Ala-Ala-Thr-Cys-Pro-Pro-Ser-Lys-Leu-Gly-Leu-
Thr-Val-Phe-Cys-Cys-Thr-Thr-Asp-Asn-Cys-Asn-His
Entsteht aus der Vorstufe (s.o.) durch Abspalten des
Signalpeptids.
Kappa-Flavitoxin
Vorkommen in
Schlange: Bungarus flaviceps (rotköpfiger Krait, Rotkopfkrait)
Anzahl der Aminosäuren: 66
Sequenz: RTCLISPSST SQTCPKGQDI CFTKAFCDRW CSSRGPVIEQ GCAATCPEFT
SRYKSLLCCT TDNCNH
Arg-Thr-Cys-Leu-Ile-Ser-Pro-Ser-Ser-Thr-Ser-Gln-Thr-Cys-Pro-Lys-Gly-Gln-Asp-
Ile-Cys-Phe-Thr-Lys-Ala-Phe-Cys-Asp-Arg-Trp-Cys-Ser-Ser-Arg-Gly-Pro-Val-Ile-
Glu-Gln-Gly-Cys-Ala-Ala-Thr-Cys-Pro-Glu-Phe-Thr-Ser-Arg-Tyr-Lys-Ser-Leu-Leu-
Cys-Cys-Thr-Thr-Asp-Asn-Cys-Asn-His
Disulfid-Brücken: 3-21, 14-42, 27-31, 46-58, 59-64
Molekulargewicht: 7259 g/mol
Kurzes
Neurotoxin 1 (Toxin V-II-1)
Vorkommen in
Schlange: Bungarus fasciatus (Gebänderter Krait, Gelber Krait)
Anzahl der Aminosäuren: 64
Sequenz: RICLNQQQST PEDQPTNGQC YIKTDCQNKT WNTHRGSRTD RGCGCPKVKP
GINLRCCKTD KCNE
Arg-Ile-Cys-Leu-Asn-Gln-Gln-Gln-Ser-Thr-Pro-Glu-Asp-Gln-Pro-Thr-Asn-Gly-Gln-
Cys-Tyr-Ile-Lys-Thr-Asp-Cys-Gln-Asn-LysThr-Trp-Asn-Thr-His-Arg-Gly-Ser-Arg-
Thr-Asp-Arg-Gly-Cys-Gly-Cys-Pro-Lys-Val-Lys-Pro-Gly-Ile-Asn-Leu-Arg-Cys-Cys-
Lys-Thr-Asp-Lys-Cys-Asn-Glu
Disulfid-Brücken: 3-6, 20-43, 45-56, 67-62
Molekulargewicht: 7272 g/mol
Wirkung: Bindet an den nicotinischen Acetylcholin-Rezeptor und
führt zu Paralyse der Skelettmuskulatur, indem die
neuromuskuläre Signalübertragung auf der postsynaptischen Seite
blockiert wird.
Fasciatoxin,
Kurzes Neurotoxin 2, (Toxin V-II-2)
Vorkommen in
Schlange: Bungarus fasciatus (Gebänderter Krait, Gelber Krait)
Anzahl der Aminosäuren: 63
Sequenz: LKCHKAQFPN IETQCKWQTL CFQRDVKPHP SSMIVLRGCT SSCGKGAMCC
ATDLCNGPST PST
Leu-Lys-Cys-His-Lys-Ala-Gln-Phe-Pro-Asn-Ile-Glu-Thr-Gln-Cys-Lys-Trp-Gln-
Thr-Leu-Cys-Cys-Phe-Gln-Gln-Arg-Asp-Val-Lys-Pro-His-Pro-Ser-Ser-Met-Ile-
Val-Leu-Arg-Gly-Cys-Thr-Ser-Ser-Cys-Gly-Lys-Gly-Ala-Met-Cys-Cys-Ala-Thr-
Asp-Leu-Cys-Asn-Gly-Pro-Ser-Thr-Pro-Ser-Thr
Disulfid-Brücken: 3-21, 15-39, 43-49, 50-55
Molekulargewicht: 6847 g/mol
Wirkung: Blockiert wie die anderen Gifte die neuromuskläre
Übertragung von Signalen. Im Gegensatz zu anderen
Bungarus-Giften ist die Wirkung dieses Toxins reversibel.
Unübliche Aminosäure-Sequenz, die von dem Schema anderer Toxine
abweicht.
Literatur:
PDB-ID: 1KBA: Dewan,
J. C., Grant, G. A., Sacchettini, J. C.: Crystal structure of
kappa-bungarotoxin at 2.3-A resolution. Biochemistry 33 pp. 13147
(1994)
PDB-ID: 2ABX: Love, R. A., Stroud, R. M.: The crystal structure
of alpha-bungarotoxin at 2.5 A resolution: relation to solution
structure and binding to acetylcholine receptor. Protein Eng 1
pp. 37 (1986)
http://www.ii.uib.no/bio/i282/1997/snake-sequences.html
http://www.vs-c.de/vsengine/vlu/vsc/de/ch/8/bc/vlu/biotoxine/tiergifte.vlu/Page/vsc/de/ch/8/bc/biotoxine/schlangengift.vscml.html
http://www.gifte.de/Gifttiere/bungarus-arten.htm
http://www.ebi.ac.uk/interpro/potm/2004_6/Table.htm
http://www.ebi.uniprot.org/entry/P60615, http://www.ebi.uniprot.org/entry/P60616, http://www.ebi.uniprot.org/entry/P01398, http://www.ebi.uniprot.org/entry/P15816,, http://www.ebi.uniprot.org/entry/P15817, http://www.ebi.uniprot.org/entry/O12961,, http://www.ebi.uniprot.org/entry/O12962 und verwandte Seiten
Dieter Mebs, Gifttiere, WVG-Verlag.
Amino acid sequence of alpha-bungarotoxin from the venom of
Bungarus multicinctus: D. Mebs, et al.; BBRC 44, 711 (1971)
Elapid neurotoxins. Purification, characterization, and
immunochemical studies of alpha-bungarotoxin: D.G. Clark, et al.;
Biochemistry 11, 1663 (1972)
Purification, properties and amino acid sequence of
alpha-bungarotoxin from the venom of Bungarus multicinctus: D.
Mebs, et al.; Hoppe Seylers Z. Physiol. Chem. 353, 243 (1972)
http://www.kingsnake.com/toxinology/LD50/ld50iv.html
http://www.gifte.de/Gifttiere/ld50_intraperitoneal.htm
http://www.serpenti.it/velenosi/ld50.htm
Kraits auf Wikipedia: https://de.wikipedia.org/wiki/Kraits - https://en.wikipedia.org/wiki/Bungarus
https://www.goruma.de/tiere/reptilien/giftschlangen/gelbgebaenderter-krait-bungarus-fasciatus
Slowinski: https://en.wikipedia.org/wiki/Joseph_Bruno_Slowinski
Chemie der Gifte
Andere pharmazeutische Seiten
![]() Home
Home
©
Text, Graphik und Photos: Bernhard Peter 2005
Impressum