Bernhard
Peter
Schlüsselenzym:
Die Reverse Transkriptase
Die
Reverse Transkriptase – der Übersetzer
Der Virus
bringt RNA als
Informationsmaterial in die Zelle ein, diese wird in DNA
umgeschrieben, ein in der Molekularbiologie einmaliger Vorgang.
Diese Übersetzung von viraler Information in eine Form, die
von
der eigenen Erbinformation nicht zu unterscheiden ist und in
diese eingebaut wird, nimmt ein Enzym namens Reverse
Transkriptase vor, ein Schlüsselenzym der HIV-Vermehrung.

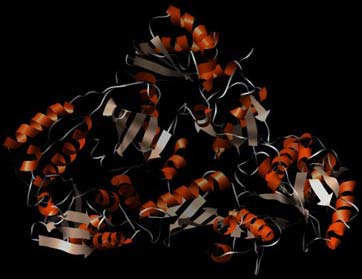
Abbildung der Reversen Transkriptase von HIV-1 ohne Ligand (Protein Data Base PDB-ID: 1DLO). Zur besseren Übersichtlichkeit ist hier nur die Sekundärstruktur (Helix und Faltblatt) wiedergegeben.
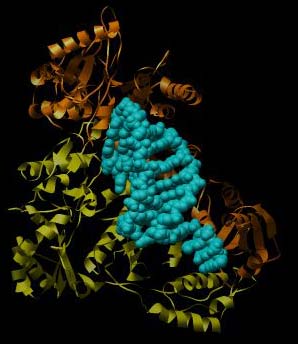
Abbildung der Reversen Transkriptase von HIV-1 mit einem Stück RNA (Protein Data Base PDB-ID: 1HVU). Zur besseren Übersichtlichkeit ist hier nur die Sekundärstruktur (Helix und Faltblatt) der RTase wiedergegeben. Deutlich zu erkennen ist hier die Zusammensetzung aus zwei Ketten und Aufteilung in zwei Funktionalitäten: Orange ist die Polymerase, gelb ist die Nuklease. In cyan mit sphärischen Atomen dargestellt das Stück RNA im aktiven Zentrum der Polymerasefunktion.
Die
Reverse Transkriptase - ein Januskopf:
Das Enzym
hat eine doppelte
Funktionalität, und entsprechend ist sie auch aus zwei
verschiedenen Polypeptidketten aufgebaut - die Reverse
Transkriptase ist sowohl eine Polymerase als auch eine Nuclease.
Die Polymerase ergänzt einsträngige RNA mit einem
Komplementärstrang DNA. Wie zwei Arme umgeben die beiden Zonen
der Polymerase den werdenden Doppelstrang aus RNA-DNA-Hybrid.
Danach tritt die zweite Funktionalität in Aktion, das zweite
Gesicht der Reversen Transkriptase, nämlich die Nuklease.
Für
diese Funktion ist die zweite Polypeptid-Kette zuständig. Sie
entfernt die ursprüngliche RNA, die aus dem Virus stammt,
indem
sie sie in kleine Stücke zerschneidet. Das Ergebnis ist jetzt
einzelsträngige DNA. Diese wird dann wiederum von der
Polymerase-Seite – erneutes Umdrehen des Enzyms! - mit
Nukleotiden zur doppelsträngigen DNA ergänzt. Von der
viralen
RNA ist nichts mehr übriggeblieben, die Information ist
komplett
in doppelsträngige DNA übersetzt worden, die jetzt in
das Genom
der Wirtszelle eingebaut werden kann und den Bau von sehr vielen
Viren veranlassen kann, bis die Zelle daran zugrunde geht.
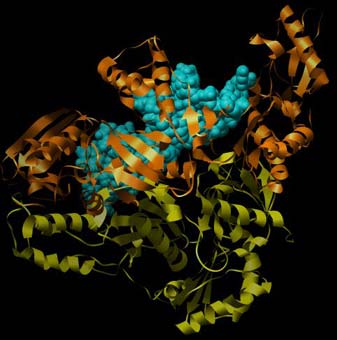
Abbildung der Reversen Transkriptase von HIV-1 mit einem Stück RNA/DNA-Hybrid (Protein Data Base PDB-ID: 1HYS). Zur besseren Übersichtlichkeit ist hier nur die Sekundärstruktur (Helix und Faltblatt) der RTase wiedergegeben. Deutlich zu erkennen ist hier die Zusammensetzung aus zwei Ketten und Aufteilung in zwei Funktionalitäten: Orange ist die Polymerase, gelb ist die Nuklease. In cyan mit sphärischen Atomen dargestellt das Stück RNA/DNA-Hybrid im aktiven Zentrum der Polymerasefunktion.
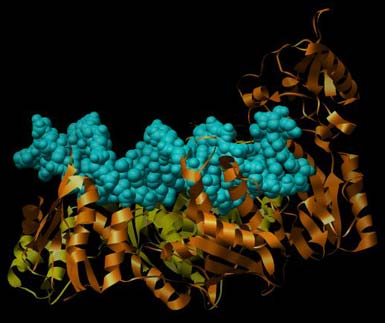
Abbildung der Reversen Transkriptase von HIV-1 mit einem Stück RNA/DNA-Hybrid (Protein Data Base PDB-ID: 1HYS). Zur besseren Übersichtlichkeit ist hier nur die Sekundärstruktur (Helix und Faltblatt) der RTase wiedergegeben. Orange ist die Polymerase, gelb ist die Nuklease. In cyan mit sphärischen Atomen dargestellt das Stück RNA/DNA-Hybrid im aktiven Zentrum der Polymerasefunktion. Besonders gut ist in dieser Darstellung die sich bildende Doppelhelix zu erkennen.
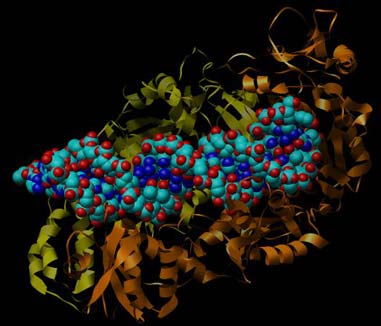
Abbildung der Reversen Transkriptase von HIV-1 mit einem Stück RNA/DNA-Hybrid (Protein Data Base PDB-ID: 1HYS). Zur besseren Übersichtlichkeit ist hier nur die Sekundärstruktur (Helix und Faltblatt) der RTase wiedergegeben. Rot sind Sauerstoffatome, dunkelblau die Stickstoffatome, cyan Kohlenstoffatome. Besonders gut zu erkennen die sich bildende Doppelhelix im aktiven Zentrum der Polymerase (orange).
Viren
und
der Geiz mit Platz
Wie stark
die Reverse
Transkriptase ein Januskopf ist, sieht man daran, daß im
Grunde
beide Teile vom selben Gen kodiert werden. Viren sind winzig, es
ist wenig Platz im Innern, die Information und Funktionalität
muß so knapp wie möglich sein. Polymerase und
Nuklease stammen
aus der selben Quelle, nur wird von der Nuklease-Einheit ein
Stück abgeschnitten, und die Polymerase-Einheit ist das
vollständige Teil. Das braucht weniger Platz als wenn man zwei
verschiedene Eiweiße kodieren müßte.
Warum
gibt
es so schnell Resistenzen?
Die Reverse
Transkriptase ist
ein schlampiges Enzym: Sie macht etwa alle 2000 Basenpaare einen
Fehler. Im Vergleich dazu ist die zelleigene Polymerase, die
über das menschliche Erbgut wacht, um ein Vielfaches genauer.
Sie verfügt außerdem über eine Art
Korrekturfunktion. Alle
2000 Basenpaare ein Fehler - das ist so wie wenn wir uns
vorstellen, daß auf jeder Schreibmaschinenseite ein
Tippfehler
wäre. Diese Schlampigkeit wäre für eine
menschliche Zelle
untragbar und für den Menschen insgesamt fatal. Aber:
Für den
Virus ist das sogar ein Vorteil, weil ständig eine gewisse
Bandbreite an Mutationen erzeugt wird. So kann der Virus relativ
schnell und einfach auf veränderte Umweltbedingungen reagieren
und sich anpassen. Wir müssen die enorme Vermehrungsrate in
Betracht ziehen: Täglich werden Millionen Viren neu gebildet.
Und unter einem gewissen Selektionsdruck wie etwa Medikamente
wird das wichtig: Manche Schreibfehler führen dazu,
daß das
Ergebnis nicht mehr richtig funktioniert. Aber auch kann ein
einziger Schreibfehler zu einem neuen Enzym führen, das
funktioniert und nicht mehr auf den Arzneistoff anspricht –
eine resistente Variante ist entstanden, die ohne Arzneimittel
eine Mutante unter vielen ist, die aber unter dem
äußeren Druck
von Arzneimitteln bald die größte Fraktion
darstellt. So kann
es passieren, daß innerhalb von wenigen Wochen resistente
Viren
entstehen, die nicht mehr auf die Arzneimittel ansprechen.
Literatur:
David S.
Goodsell, Reverse
Transcriptase,
http://www.pdb.org/pdb/static.do?p=education_discussion/molecule_of_the_month/pdb33_1.html
Research Collaboratory for Structural Bioinformatics Protein Data
Bank http://www.rcsb.org/pdb, PDB-ID: 1HVU: HUMAN
IMMUNODEFICIENCY VIRUS TYPE 1 REVERSE TRANSCRIPTASE COMPLEXED
WITH A 33-BASE NUCLEOTIDE RNA PSEUDOKNOT, Jaeger,
J., Restle, T., Steitz, T.A. The structure of HIV-1
reverse transcriptase complexed with an RNA pseudoknot inhibitor.
EMBO J. v17 pp.4535-4542, 1998.
Research Collaboratory for Structural Bioinformatics Protein Data
Bank http://www.rcsb.org/pdb, PDB-ID: 1HYS, CRYSTAL STRUCTURE OF
HIV-1 REVERSE TRANSCRIPTASE IN COMPLEX WITH A POLYPURINE TRACT
RNA:DNA, Sarafianos, S.G., Das,
K., Tantillo, C., Clark Jr.,
A.D., Ding, J., Whitcomb,
J.M., Boyer,
P.L., Hughes, S.H., Arnold, E. Crystal structure of
HIV-1 reverse transcriptase in complex with a polypurine tract
RNA:DNA. EMBO J. v20 pp.1449-1461 , 2001
Research Collaboratory for Structural Bioinformatics Protein Data
Bank http://www.rcsb.org/pdb, PDB-ID: 1DLO, Hsiou,
Y., Ding, J., Das,
K., Clark
Jr., A.D., Hughes, S.H., Arnold,
E.
Structure of unliganded HIV-1 reverse transcriptase at 2.7 A
resolution: implications of conformational changes for
polymerization and inhibition mechanisms. Structure v4
pp.853-860, 1996 HUMAN IMMUNODEFICIENCY VIRUS TYPE 1
So
funktionieren HIV-Medikamente:
Ein
Schlüsselenzym: Die Reverse
Transkriptase
So
setzt man die Reverse Transkriptase
außer Gefecht: Antimetabolite
So
setzt man die Reverse Transkriptase
außer Gefecht: nicht-nukleosidische Hemmstoffe
Schlüsselenzym
Protease: Die chemische
Schere
Wir
setzen die chemische Schere außer
Betrieb: Protease-Hemmstoffe
Zurück
zur Übersicht HIV / AIDS
Andere pharmazeutische
Seiten
![]() Home
Home
©
Copyright Text, Graphik und Photos: Bernhard Peter 2006
Impressum